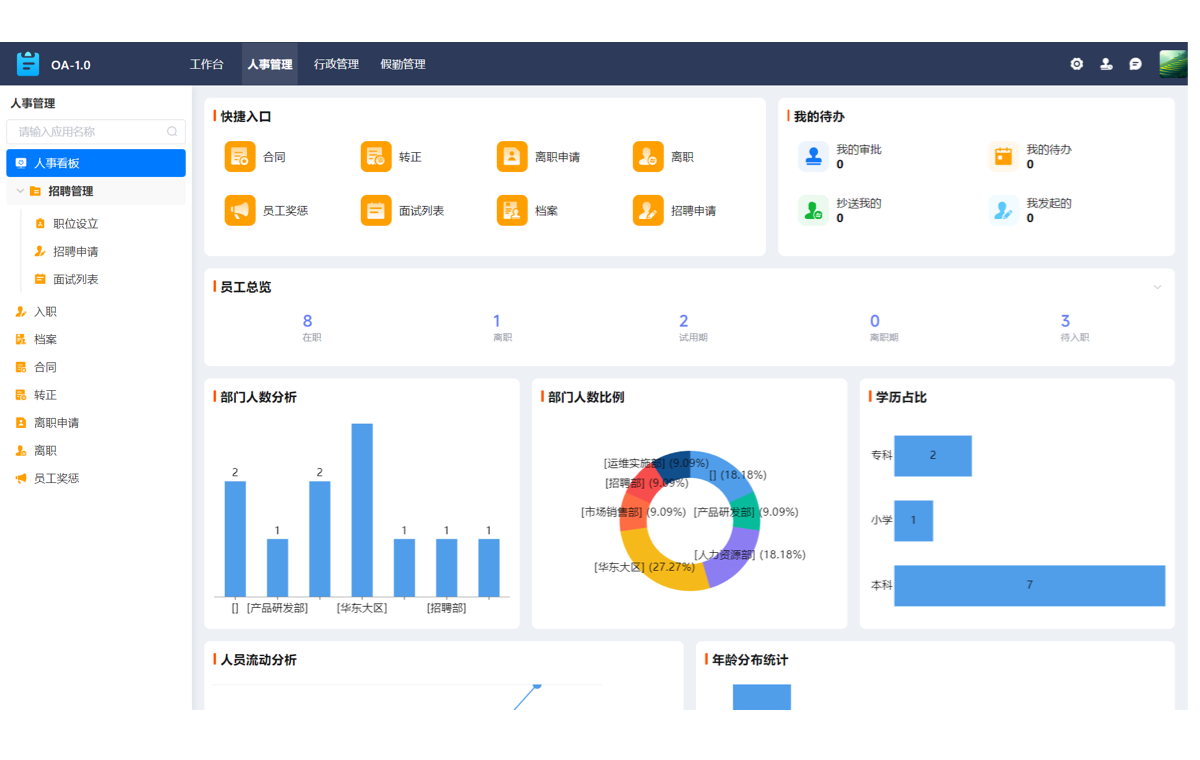
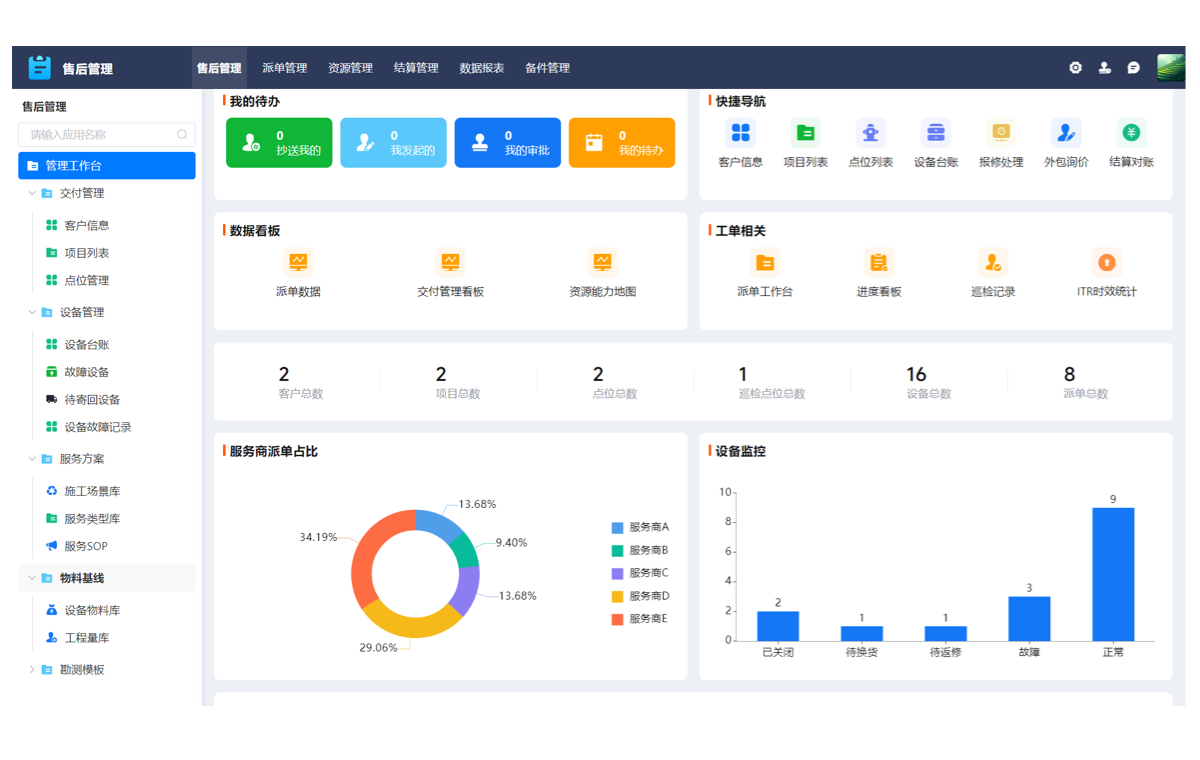
作为首席行业分析师,我们基于对中国制药行业超过5000家企业的服务数据洞察发现,一个严峻的现实正摆在所有从业者面前:在GMP强监管与市场竞争白热化的双重压力下,传统的生产管理模式已然成为企业发展的最大掣肘。数据孤岛林立,信息在研发、生产、质量等部门间传递时严重失真;流程僵化刻板,面对工艺变更或法规更新时反应迟钝;合规成本高企,大量的人力物力耗费在纸质记录的整理与追溯上。这些普遍存在的效率瓶颈,正持续侵蚀着企业的利润空间与核心竞争力。可以断言,单纯依靠增加人力或设备投入的粗放式增长已走到尽头。要破解这一困局,构建一套能够连接数据、优化流程、保障合规的先进生产管理系统,已不再是一个“可选项”,而是关乎企业生存与发展的唯一战略答案。本文将摒弃空泛的理论,从战略高度出发,结合一线实践,为企业决策者提供一套清晰、可执行的生产效率提升最佳实践框架,指引您在数字化转型的浪潮中抢占先机。
一、现状诊断:制药生产管理中的三大“隐形”效率黑洞
在深入探讨解决方案之前,我们必须精准识别制药企业在日常运营中普遍存在,却又极易被忽视的效率“黑洞”。这些问题如同潜藏在水面下的冰山,不仅消耗着宝贵的资源,更可能在关键时刻引发合规性的“触礁”风险。
1. 数据断链:从研发到生产,信息传递的“最后一公里”难题
当前,许多制药企业的数据管理仍严重依赖Excel报表、纸质批生产记录(BPR)以及部门间的邮件沟通。这种看似“灵活”的方式,实则构建了一座座难以逾越的数据孤岛。当研发部门的工艺参数需要传递给生产车间时,往往经过多次的人工转录和解读,信息的准确性与完整性大打折扣。生产过程中的关键数据,如温度、湿度、压力等环境参数,以及各工序的执行人、执行时间,大多被记录在分散的纸张上,难以进行实时监控和关联分析。
这种数据断链的后果是灾难性的。首先,它导致信息严重滞后。管理者无法实时掌握生产进度、物料消耗和质量状态,生产调度完全依赖于滞后的报表和经验判断,极易造成资源浪费和交付延期。其次,数据不一致性成为常态。不同部门、不同班次记录的数据格式、标准各异,为后续的数据整合与分析制造了巨大障碍。最致命的是,在面临国家药品监督管理局(NMPA)的GMP审计或客户的质量审查时,从成品批号反向追溯所有相关的原料、人员、设备、环境记录,变成了一项耗时数天甚至数周的艰巨任务。行业数据显示,超过60%的GMP审计缺陷与数据记录不完整、不及时、不可追溯有关,因数据问题导致的生产中断、产品召回等潜在损失每年可达数千万元。
2. 流程固化:僵化的生产流程难以响应市场与法规的快速变化
为了实现流程的规范化,部分企业引入了传统的制造执行系统(MES)或在ERP系统中集成了生产模块。然而,这些上一代的信息系统往往暴露出一个共同的弊病:流程固化。它们的业务逻辑在系统实施之初便被代码写死,任何微小的流程调整,例如增加一个质量控制点、变更一个审批节点,都需要依赖原厂商进行昂贵的二次开发,开发周期动辄数月。
在当前快速变化的市场环境中,这种僵化的系统架构显得力不从心。一方面,新药研发上市的节奏不断加快,生产线需要具备快速切换生产品种、调整工艺路线的柔性能力。另一方面,GMP等行业法规也在持续更新,要求企业的质量管理流程(如偏差处理、变更控制、CAPA)能够迅速响应新的合规要求。当企业的生产管理系统无法跟上业务与法规的变化速度时,生产计划便会频繁中断,工艺变更的执行周期被无限拉长。企业要么选择“削足适履”,让业务流程去适应僵化的系统,牺牲运营效率;要么选择回归线下,用纸质表单处理新流程,导致新的数据孤岛产生,这无疑是数字化进程的倒退,严重拖累了企业的整体运营效率和市场响应能力。
二、战略升级:构建新一代制药生产管理系统的四大核心支柱
要从根本上解决上述效率黑洞,企业需要的不是对现有系统的修修补补,而是一次彻底的战略升级。新一代的制药生产管理系统,必须是一个能够适应变化、连接万物、驱动决策的“智慧生命体”。从顶层设计来看,这样一套系统必须构建在以下四大核心支柱之上:
-
支柱一:高度的灵活性与可扩展性 (Agility & Scalability)这代表了系统的“进化能力”。一个高效的系统必须能够让企业自主、快速地响应业务变化。它应提供可视化的配置工具,允许业务人员或IT人员通过“拖拉拽”的方式,而非编写代码,来修改和创建业务流程、数据表单和统计报表。无论是为了优化批生产记录的SOP,还是为了应对新的GMP条款调整偏差处理流程,系统都应能在数小时或数天内完成调整并上线。这种“随需而变”的能力,确保了数字化系统能够始终与企业的业务发展保持同步,避免了因系统僵化而被业务淘汰的命运,从而保护了企业的长期IT投资。其底层架构必须是可扩展的,能够随着企业规模的扩大、业务线的增加而平滑升级,支撑企业未来5-10年的发展。
-
支柱二:端到端的数据整合与追溯能力 (Data Integration & Traceability)这代表了系统的“神经网络”。新一代系统必须能够打破部门墙,成为企业统一的数据中枢。它需要具备强大的集成能力,通过标准的API接口,无缝对接企业现有的ERP(企业资源计划)、LIMS(实验室信息管理系统)、QMS(质量管理系统)、WMS(仓库管理系统)以及生产车间的各类设备(如PLC、SCADA)。通过这种连接,实现从原辅料入库、生产投料、过程控制、质量检验,到成品入库、最终放行的全生命周期数据自动采集与贯通。最终形成一个完整、可靠、不可篡改的电子数据链。当任何质量问题发生时,只需输入批号,系统便能在一分钟内呈现出所有相关的“人、机、料、法、环、测”信息,实现真正意义上的“一键追溯”,从容应对最严苛的合规审计。
-
支柱三:强大的流程引擎驱动能力 (Process-Driven Automation)这代表了系统的“执行大脑”。制度写在纸上、挂在墙上,不等于能够被严格执行。新一代系统必须内置一个强大的流程引擎,将企业的标准操作程序(SOP)、管理规范和GMP要求,转化为系统中自动流转、强制执行的业务流程。从生产指令的下达、物料的申请与核对,到SOP步骤的确认、偏差的报告与处理,再到变更的申请与审批,每一个环节都由流程引擎精确驱动。系统自动将任务推送给指定岗位的人员,设定处理时限,并记录下每一步的操作日志。这不仅将员工从繁琐的流程性工作中解放出来,更重要的是,它确保了制度的100%落地,消除了因人为疏忽、遗忘或“抄近路”而带来的质量与合规风险。
-
支柱四:实时的数据分析与决策支持能力 (Real-time Analytics & Decision Support)这代表了系统的“智慧洞察”。数据的价值在于被分析和利用。一个先进的系统绝不能仅仅是一个数据记录工具,更应该是一个强大的决策支持平台。它必须提供灵活的报表引擎,让管理者可以像搭建积木一样,通过拖拉拽的方式,自由组合数据,生成自己关心的管理驾驶舱。例如,实时监控各产线的OEE(设备综合效率)、批次生产进度、物料平衡情况、质量合格率趋势等关键绩效指标(KPI)。通过多维度、可视化的数据看板,管理者能够第一时间洞察生产瓶颈、发现异常波动、预测潜在风险,从而做出更科学、更及时的管理决策,将企业管理从“凭经验”升级为“用数据说话”。
三、实践路径(一):以“流程引擎”驱动生产全过程的标准化与自动化
理论的落地需要具体的路径。构建新一代生产管理系统的第一步,便是利用其核心的“流程引擎”,将过去依赖人工、纸张和口头传达的生产流程,改造为标准化、自动化、可视化的线上流程。这不仅是效率的飞跃,更是管理规范性的质变。
强大的流程引擎允许企业将复杂的业务逻辑,如SOP执行、偏差处理、变更控制等,转化为清晰的线上流程图。通过简单的拖拉拽操作,即可定义流程的每一个节点(如申请、审核、执行、复核),并为每个节点配置负责人、处理时限和流转条件。这种方式彻底取代了传统僵化的代码开发,赋予了企业随需应变的能力。
下表清晰地对比了在几个关键生产场景下,“传统人工流程”与基于流程引擎的“自动化流程”之间的巨大差异:
| 业务场景 | 传统模式痛点 | 自动化流程优势 |
|---|---|---|
| 批生产记录 (BPR) | 纸质记录易出错、易丢失、难追溯;人工复核耗时耗力,签名真实性难保证;数据需二次录入统计,严重滞后。 | 电子批记录(EBR)模板化,SOP步骤强制执行,关键数据自动采集;流程节点自动流转复核,采用电子签名(符合FDA 21 CFR Part 11);数据实时生成,无需人工统计。 |
| SOP执行 | 依赖员工记忆和自觉性,执行过程无法有效监控;版本更新后,无法确保所有人都使用最新版本;培训成本高。 | SOP内嵌于流程中,系统引导操作员按步骤执行,关键步骤需扫码或确认后方可继续;SOP版本在线统一管理,更新后旧版自动失效;极大降低培训难度和执行偏差。 |
| 偏差处理 | 发现偏差后,通过电话、邮件汇报,流程不清晰;纸质表单流转慢,责任人不清,处理过程难追踪;CAPA措施的执行与验证脱节。 | 线上发起偏差报告,流程自动触发,根据偏差等级流转至QA、生产等部门;系统自动记录各节点处理耗时,超时预警;CAPA任务自动生成并指派,与偏差记录关联,形成闭环管理。 |
| 变更控制 | 变更申请、评估、审批过程漫长,涉及多部门协调困难;变更影响评估依赖专家经验,易有疏漏;变更执行情况难以追踪。 | 线上提交变更申请,自定义评估和审批流程,并行会签,大幅缩短周期;系统可关联所有受影响的文件、物料、设备,评估更全面;变更任务状态实时可见,确保所有措施按计划执行。 |
1. 案例分析:某药企如何通过自定义流程,将偏差处理周期缩短70%
以我们服务的一家国内领先的生物制药企业为例。此前,该企业的偏差处理流程完全依赖纸质表单和邮件。一个普通的生产偏差,从车间发现、上报,到QA介入调查,再到多部门会签制定纠正与预防措施(CAPA),整个流程走完平均需要15-20个工作日。流程不透明,各部门之间经常出现推诿和等待,严重影响了生产连续性,且在GMP审计中多次因此被提出缺陷项。
引入具备强大流程引擎的生产管理系统后,该企业首先做的就是将偏差处理流程“搬到”线上。QA部门的负责人与IT人员一起,通过拖拉拽的方式,在短短2天内就配置出了一套完全符合其内部SOP的线上偏差处理流程。新流程实现了:
- 一键上报:车间任何员工发现偏差,可立即通过手机或PC端的表单上报,附上现场照片,信息直达QA部门。
- 智能流转:系统根据预设规则(如偏差等级),自动将报告流转给指定的调查员和审批人,并发送待办事项提醒。
- 限时处理:每个流程节点都设定了标准的处理时限,系统自动催办,并将各环节耗时记录在案,作为绩效考核依据。
- 闭环管理:CAPA措施被创建为关联任务,指派给具体负责人,系统会持续追踪任务状态,直至完成并验证有效性。
实施新流程后,该企业的偏差平均处理周期从原来的15个工作日骤降至4.5个工作日,缩短了70%。流程全程留痕、透明可追溯,不仅极大地提升了运营效率,更使其在最近一次的GMP审计中,因其高效、规范的偏差管理体系而获得了审计官的高度评价。
四、实践路径(二):以“数据引擎”赋能质量管理与数据驱动决策
如果说“流程引擎”构建了企业高效运转的“骨骼”,那么“数据引擎”则为其注入了感知、分析与决策的“血液”与“大脑”。一个现代化的生产管理系统,必须具备强大的数据采集、整合与分析能力,将沉睡在纸张和孤立系统中的数据唤醒,转化为驱动质量提升和科学决策的宝贵资产。这主要依赖于系统的两大核心组件:“表单引擎”和“报表引擎”。
1. 质量追溯与QMS:从原料入库到成品放行的全链条数字化
质量管理的核心在于数据的完整性与可追溯性。传统的纸质记录方式是实现这一目标的最大障碍。“表单引擎”正是解决这一难题的利器。它允许企业将所有纸质的记录表单,如原辅料检验报告、环境监测记录、清洁验证记录、中间品检验单、成品检验报告以及复杂的批生产记录(BPR),通过拖拉拽的方式,快速转化为结构化的电子表dan。
这种转变带来的价值是革命性的:
- 数据源头采集:检验员、操作工可以直接在平板电脑或工位PC上填写数据,系统可以集成电子秤、温湿度传感器等设备,实现关键数据的自动采集,从源头上杜ax绝了转录错误和数据造假的可能性。
- 构建质量数据链:所有电子化的表单数据都自动与物料批次、生产批次、设备编号、操作人员等关键信息关联起来,存储在统一的数据库中。这就构建了一条从原料供应商到成品客户的全链条数字化档案。
- 实现一键追溯:当需要进行质量追溯时,无论是正向追溯(根据原料批号查找所有使用该原料的成品),还是反向追溯(根据成品批号查找所有相关的生产和质量记录),都可以在系统中瞬间完成。面对GMP审计官关于“某年某月某日某批次产品”的提问,企业负责人可以当场在系统中调出完整的、不可篡改的电子记录,从容自信。这不仅极大地提升了审计效率,更是企业质量管理水平的有力证明。
2. 数据看板:为管理者打造实时、多维度的生产“作战指挥室”
数据采集上来只是第一步,更重要的是如何利用这些数据。这就需要强大的“报表引擎”。传统的报表制作方式是IT人员通过复杂的SQL查询和报表工具开发,周期长、不灵活,无法满足管理者多变的数据分析需求。
现代生产管理系统中的“报表引擎”则完全不同。它赋予了管理者“自助式分析”的能力。管理者可以根据自己的需求,通过拖拉拽的方式,选择数据源(如生产订单、质量检验、设备状态等),并选择合适的图表组件(如折线图、柱状图、饼图、仪表盘等),自由组合成个性化的数据看板。
一个典型的生产管理“作战指挥室”看板可能包含以下内容:
- 生产进度看板:实时显示各生产订单的完成进度、各工序的在制品数量,与计划进度进行对比,延期风险一目了然。
- 设备OEE看板:实时展示各关键设备的OEE(设备综合效率)及其构成(时间稼动率、性能稼动率、合格品率),帮助快速定位设备瓶颈。
- 物料消耗看板:动态追踪各批次生产的物料实际消耗与BOM标准用量的差异,及时发现异常损耗。
- 质量趋势看板:按产品、产线、时间等维度,统计分析产品合格率、不合格项分布、偏差发生频率等,帮助QA部门精准定位质量问题的根本原因。
通过这些实时、多维度的可视化看板,企业高层管理者能够摆脱对滞后报表的依赖,像指挥作战一样,实时掌控生产全局,洞察细微的异常波动,从而做出更快速、更精准的决策,将潜在问题扼杀在摇篮之中。
五、选型指南:如何选择真正适合业务发展的生产管理系统?
当企业决策者认识到生产管理系统的重要性后,下一个挑战便是如何在纷繁复杂的市场中,选择一款真正适合自身业务发展需求的系统。错误的选型不仅意味着资金的浪费,更可能导致数字化项目失败,挫伤团队信心。为此,我们为企业高管提供一个清晰的“选型坐标系”,在评估系统时,务必考察以下5个关键标准:
-
1. 系统的个性化与扩展性这是最重要的评估标准。您需要问的第一个问题是:“当我的业务流程在3个月后需要调整时,这个系统能否支持我快速、低成本地完成修改?” 一款优秀的系统必须具备高度的灵活性,能够适应企业独特的管理模式和未来的业务变化。考察其是否提供无代码/低代码的配置能力,允许业务人员自主调整流程、表单和报表。这决定了系统是能够与企业共同成长的“活系统”,还是一个上线即固化的“死系统”。
-
2. 与现有系统(如ERP/LIMS)的集成能力生产管理系统不是一个孤岛,它必须能够融入企业现有的IT生态。评估系统是否提供标准、开放的API接口,能否与您正在使用的ERP、LIMS、WMS等系统实现顺畅的数据对接。一个好的系统应该能轻松打通计划层与执行层,实现订单、库存、BOM、质量数据等的双向同步,从而构建完整的信息流闭环,实现真正的业财一体化和产供销协同。
-
3. 是否支持私有化部署以保障数据安全对于制药行业而言,生产工艺、批记录等核心数据是企业的生命线。因此,数据安全是不可逾越的红线。在选型时,必须明确供应商是否支持私有化部署方案,即将整套系统和所有数据部署在企业自有的服务器或指定的云服务器上。这确保了企业对数据拥有100%的掌控权,完全杜绝了核心数据泄露的风险,满足了制药行业对数据安全和知识产权保护的严苛要求。
-
4. 供应商的服务能力与行业经验软件的成功实施,技术只占一部分,供应商的服务能力和行业理解同样至关重要。考察供应商团队是否深刻理解制药行业的GMP法规要求和业务痛点,能否提供从需求梳理、方案设计、实施部署到后期运维的全方位专业服务。选择一个拥有丰富制药行业案例、能够提供原厂服务的供应商,远比选择一个只懂技术的通用型软件代理商要可靠得多。
-
5. 投入产出比(TCO)而非仅仅是初始采购成本精明的决策者关注的是总拥有成本(TCO),而不仅仅是眼前的软件采购费。TCO包括了初始的软件许可费、实施服务费,以及未来数年的运维费、二次开发费、升级费等。一款看似初期便宜但流程固化的系统,其后期的修改和维护成本可能是一个天文数字。相反,一款具备高度灵活性、允许企业自主维护和迭代的系统,虽然初始投入可能略高,但其长期的TCO反而更低,投入产出比更优。
结语:拥抱变革,以“无代码”平台构建企业核心竞争力
综上所述,在高度不确定和激烈竞争的市场环境中,制药企业提升效率、保障合规的根本出路,在于构建一套能够“随需而变”的数字化生产管理系统。这套系统必须具备高度的灵活性、强大的集成能力和深度的数据洞察力。传统的套装软件过于僵化,完全自主开发又成本高昂、周期漫长,而“无代码/低代码”平台的出现,则为企业提供了实现这一目标的理想路径。它完美兼具了套装软件的稳定性与自主开发的灵活性。
在此,作为长期观察和服務于企业数字化转型的行业分析师,我们必须提及,像支道平台这样的无代码应用搭建平台,正是为解决上述所有挑战而设计的。它通过提供业界领先的表单引擎、流程引擎、报表引擎等核心组件,让企业不再需要编写一行代码,只需通过拖拉拽的方式,就能快速、低成本地构建出完全符合自身需求的个性化生产管理应用,真正实现效率的提升与制度的落地。我们相信,未来的核心竞争力,不属于那些购买最昂贵软件的公司,而属于那些能够利用先进工具,快速构建并持续优化自身独特管理模式的企业。
立即访问官网,申请免费试用,亲身体验如何为您的企业量身定制一套能够支撑未来十年发展的生产管理系统。
关于制药生产管理系统的常见问题
1. 实施一套新的生产管理系统,对我们现有的GMP体系有何影响?
解答:一个设计精良的现代化生产管理系统,不仅不会冲击您现有的GMP体系,反而会成为GMP体系落地执行的有力支撑和固化工具。首先,它能将您书面的标准操作程序(SOP)和管理规程,转化为系统中强制执行的、标准化的线上流程,确保每一项操作都符合GMP要求,杜绝“走捷径”的可能。其次,系统能够生成完整的、不可篡改的、带有时间戳的电子记录(ERES),并建立清晰的审计追踪(Audit Trail),这完全符合FDA 21 CFR Part 11等法规对电子记录和电子签名的要求。这不仅极大提升了日常操作的合规性,更让您在面对官方审计时,能够提供即时、准确、可靠的数据证据,显著提升审计的效率和通过率。
2. 我们已经有ERP系统了,还需要单独的生产管理系统(MES)吗?
解答:这是一个非常普遍且重要的问题。ERP(企业资源计划)与MES(制造执行系统,或更广义的生产管理系统)在功能定位上有着本质的区别,两者是互补而非替代关系。ERP的核心在于管理企业的宏观资源计划,如财务、采购、销售、库存等,它回答的是“生产什么”和“需要多少物料”的问题。而MES则聚焦于生产车间的“黑匣子”,负责从接收生产订单到产出成品的全过程管控,它回答的是“如何生产”、“生产过程是否合规”、“生产进度如何”等执行层面的问题。现代的生产管理系统(特别是基于无代码平台构建的系统)能够通过API与ERP无缝对接,从ERP接收生产计划和BOM,并将生产进度、物料消耗、完工数据实时回传给ERP,打通计划层与执行层的数据流,实现真正的业财一体化和产供销高效协同。
3. 无代码平台开发的系统,其稳定性和安全性是否能满足制药行业的要求?
解答:对于稳定性和安全性,制药行业的要求确实是最高级别的。关于这一点,可以从两方面来看。首先,领先的无代码平台,其底层架构是经过数千家企业级应用(包括许多大型制造企业)长期、高并发使用的验证,是标准化的、成熟且极其稳定的。它并非为每个客户从零开发,而是提供一个坚实的平台基础。其次,在安全性方面,专业的无代码平台供应商(如支道平台)通常会提供私有化部署选项。这意味着整套系统,包括应用和所有核心生产数据,都可以部署在企业自有的内部服务器或专属的云环境中,与公网物理隔离。企业拥有数据的完全控制权,所有访问都在企业内部防火墙的保护之下,这从根本上保障了工艺配方、生产记录等核心知识产权和商业机密的安全,完全能够满足制药行业对数据主权和安全的严苛要求。